Dopo Rutherford i fisici si domandarono se esistessero altre particelle elementari oltre ai protoni e gli elettroni e contemporaneamente
se i protoni e gli elettroni fossero veramente elementari.
Ma per rispondere alla domanda un po’ più in dettaglio dobbiamo trovare i costituenti davvero elementari della materia, e capire come
interagiscono per creare l’incredibile varietà del nostro mondo.
Lo studio della costituzione della materia ha portato Rutherford a dimostrare che esistono gli atomi,
con gli elettroni che ruotano attorno al nucleo centrale carico positivamente .
Partendo da questa scoperta gli scienziati si sono mossi alla ricerca di componenti elementari costituenti gli elettroni, protoni e
successivamente i neutroni.
L'esistenza del neutrino (rivelato sperimentalmente solo nel 1955) implicava l'esistenza di una quarta forza fondamentale della natura,
l’iterazione debole, responsabile della trasformazione di un neutrone in un protone (o viceversa) nel decadimento beta.
Si tentò allora di spiegare le nuove forze nucleari con una teoria che fosse l'analogo dell'elettromagnetismo: come la forza tra elettroni
era dovuta allo scambio di un quanto di luce, così la forza tra i nucleoni (protoni e neutroni) poteva attribuirsi a un analogo quanto.
Premesse
All'inizio del XX secolo erano noti moltissimi spettri di emissione della luce proveniente dagli atomi che erano alcune linee discrete e ben distinte poste associabili a luce di differenti e ben precise frequenze.
Nel 1884 Johann Balmer osservò che alcune righe dello spettro di emissione
dell'idrogeno potevano essere ricavate utilizzando la formula:
![]()
Successivamente Johannes Rydberg e Walter Ritz ricavarono questa legge sperimentale in grado di spiegare tutte le righe di emissione dell'atomo di idrogeno
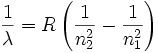
con n1>n2 ed R la costante di Rydberg.
Modello Planetario
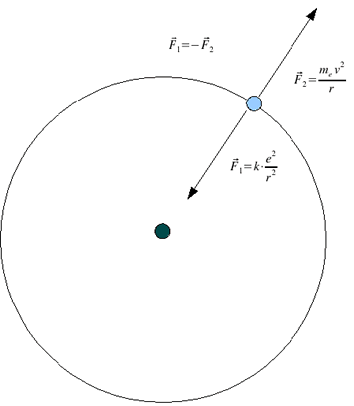
Forza centripeta = Forza elettrostatica = K e2 / R2
Forza centrifuga = m V2 / R
In queste condizioni esso potrebbe stazionare a qualsiasi distanza dal nucleo, ma questo contrasta sia con quanto previsto dalla teoria sia dagli eventi sperimentali.
-
Un elettrone che accelera in un campo elettrico deve perdere energia e di conseguenza cadere sul nucleo dopo pochi secondi.
-
Un elettrone che perde energia trasferisce la stessa a un fotone di energia hν (dove ν è la frequenza della radiazione presa in esame), energia pari a quella persa dall'elettrone, quindi lo spettro dell'atomo d'idrogeno dovrebbe essere continuo e non a righe come verificato sperimentalmente.
Bohr e la quantizzazione del momento angolare
Per superare quanto sopra contestato, Bohr ha ipotizzato che, per motivi non meglio precisati, un elettrone può permanere indefinitamente solo su orbite che rispettano le seguenti condizioni:
-
K e2 / R2 = m V2 / R
-
mVR = n h (quantizzazione del momento angolare)
h= costante di Plank
Imponendo tali condizioni si ricava:
K e2 / R2 = m V2 / R
K e2 = m V2 R
m K e2 R = ( m V R)2 = (nh)2
R= n2 [ h2 / (m K e2)] = n2 R0
essendo i termini racchiusi tra le parentesi quadre tutti associati a costanti si ricava che il raggio ossia la distanza dal nucleo in cui si può trovare un elettrone risulta essere proporzionale a n (numero appartenente all'insieme dei numeri naturali (N)) al quadrato.
E(n)= - 1/2 K e2 / R = - 1/n2 [ 1/2 m K2 e4 / h2] ossia inversamente proporzionale all'inverso del quadrato di n.
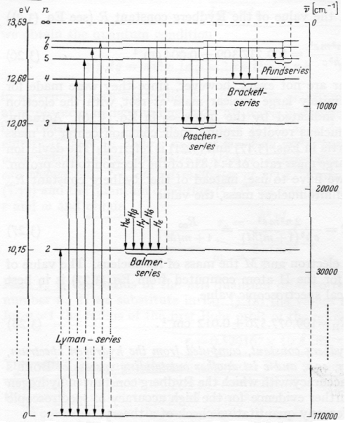
L'energia rilasciata da un elettrone che passa da un livello n2 a un livello n1 con la creazione di un fotone di energia hν = E(n2) -E(n1)
ossia la frequenza(ν) :
ν =
RH ( 1/n12 -1/n22)
è quella rilevata sperimentalmente nel caso dell'atomo di idrogeno.
Quanto ricavato non vale per gli
altri atomi. Perchè?
Perché si deve quantizzare il momento
della quantità di moto?
